Periyodik Tablonun Tarihçesi
Bilim insanları yeni elementler keşfettikçe bunları bir düzen içine sokma ihtiyacı hissetmişlerdir.
Periyodik tablonun tarihçesi konumuzda daha fazla ayrıntı bulacağınız bu olay sonunda elementlerin atom numarasına göre düzenli bir şekilde sıralandığı Periyodik tablo meydana getirilmiş böylece elementler arasındaki ilişki daha anlaşılır bir yapıya bürünmüştür.
Bizler, zaman içinde birçok değişikliğe maruz kalan periyodik tablonun meydana gelmesinde büyük katkıları olan iki bilim insanı Dmitiri Mendeleev ve Henry Moseley’in çalışmalarına kısaca değineceğiz.
Dmitri Mendeleev (1834 – 1907)
Öğretmen bir babanın çocuğu olan Mendeleev, babasının işini kaybetmesi sonucu zor şartlara sahip bir çocukluk geçirdi. Kimya derslerinde gördüğü eksikliklerden dolayı “Kimyanın ilkeleri” adlı bir kitap yayımlamıştır.
Bu çalışma sırasında o zamana kadar bilinen elementler arasında bir ilişki bulmak amacıyla çalışmalarını derinleştirmiştir.
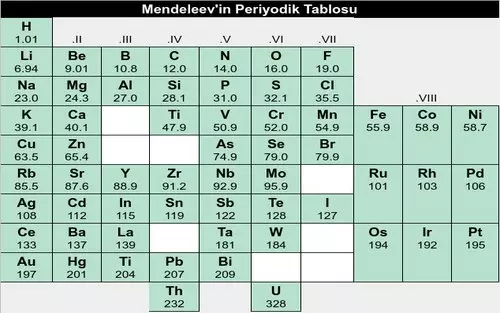
Elementleri atom kütlelerine göre sıraladığında belirli özelliklerin tekrar edildiğini ilk olarak O görmüştür. Ardından bilinnen 63 elementin tamamınının atom kütlerine göre sıralandığı “Periyodik Tablo” yu meydana getirmiştir.
Periyodik tabloda olması gereken fakat henüz keşfedilmeyen atomların yerini ise boş bırakmıştır.
Bu durum onun yaptığı periyodik tablonun geçerliliğini de göstermiştir çünkü Mendeleev’in ölümünden sonra bıraktığı boşluklara gelecek olan elementler keşfedilmiştir.
Henry Moseley (1887 – Weymouth / 1915 – Çanakkale)
Mendeleev’in yaptığı periyodik sistem uzun yıllar kullanıldı ve bilim insanlarına çok yardımcı oldu fakat O’nun kullandığı sistemde atomlar atom ağırlıklarına göre düzenlenmişti ve bir çok element bu nedenle periyodik tabloya eklenemiyordu çünkü elementin atom kütlesine göre olması gereken yer ile sahip olduğu özellik birbirini tutmuyordu.
Bu sıkıntıdan dolayı Mendeleev söz konusu elementleri tablosuna almadı. Mendeleev’e göre bu elementlerin kütleleri yanlış hesaplanmış olmalıydı.
Moseley, X ışınları üzerinde yaptığı çalışmalarda her atomun farklı bir spektruma sahip olduğunu gördü yani atom numarası değiştikçe spektrum da değişiyordu ayrıca atom numarası ile proton sayısı arasında da bir ilişkinin olduğunu fark etti.
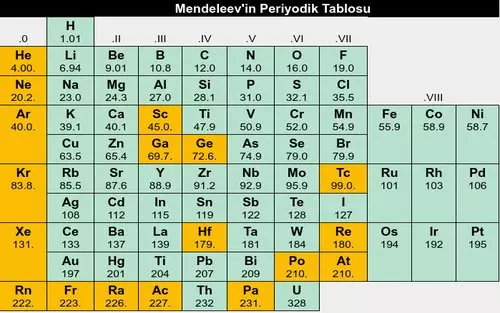
Bu çalışmalarının sonrasında atomları atom numaralarına (proton sayısı) göre dizerek bir periyodik tablo oluşturdu. Bu tabloda 43, 61, 72 ve 75 numaralı kısımlar boş kalmıştı. Moseley buralardaki elementlerin keşfedilmediğini söyleyerek ileride bulunacağını tahmin etti.
Gerçekten de O’nun ölümünden sonra bu elementler bilim adamları tarafından bulunmuştur.

Biliyor musunuz?
1915 yılında İngiliz ordusuna katılarak Çanakkale’ye gelen Moseley, bir Osmanlı askeri tarafından öldürülmüştür.
Elementlerin Periyodik Tabloya Yerleştirilmesi
Periyot, belli bir düzen içinde tekrarlayan durumlar için kullanılır.
Örneğin aracınızın bakımlarını periyodik olarak yapınız denildiğinde kastedilen şey o aracın bakımının sürekli tekrar edilmesidir.
Bilim insanları atomları atom numaralarına göre sıraladıklarında belirli özelliklerin daima tekrar edildiğini gördüler ve bunun sonucunda oluşturdukları tabloya “Periyodik tablo” adını verdiler.
Belirli bir kural dahilinde elementlerin yerleştiği bu tablo iki kısımdan oluşmaktadır; sütunlar yani gruplar ve sıralar yani periyotlar.
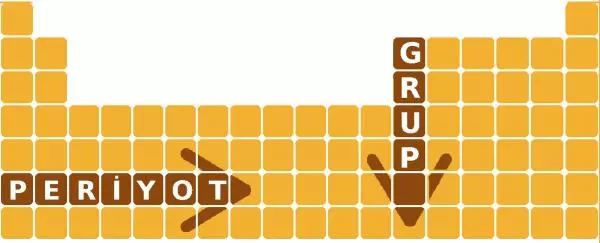
Periyodik tabloda toplamda 18 tane grup bulunur. Bunların 10 tanesi B grubunu meydana getirirken, 8 adet de A grubu bulunur.
7 tane periyodun yer aldığı periyodik tabloya, elementler belli bir kural dahilinde yerleştirilir.
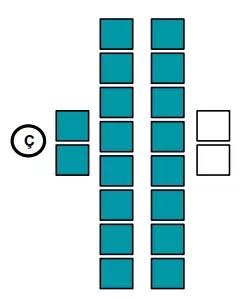
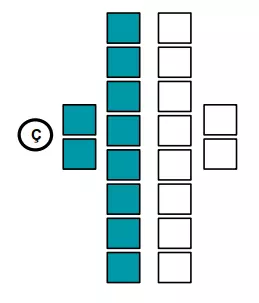
İlk 20 element için oldukça basit olan bir kural ile yerleştirme işlemine göz atalım.

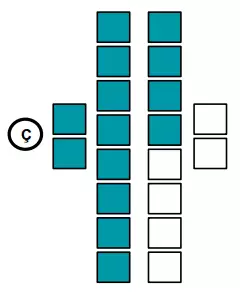
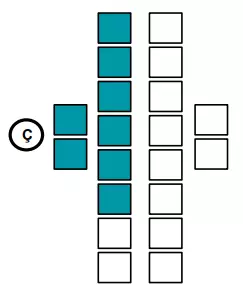
- Elektronlar çekirdeğe (Ç) yakın katmandan başlayarak yerleştirilir,
- Her kutuya sadece 1 elektron gelebilir,
- İlk katmana en fazla 2 elektron, ikinci ve üçüncü katmana en fazla 8 elektron, son katmana ise en fazla 2 elektron yerleşir,
- Katman dolmadan sonraki katmana elektron yerleştirilmez.

- 1
Elektronları katmanlara yerleştirdiğimizde son katmandaki elektron sayısı grup numarasını, katman sayısı ise periyot numarasını verir.
Örneğin sodyum ve Bor elementinin periyodik tablodaki yerini bulalım. Sodyum’un nötr haldeki elektron sayısı 11, Bor elementinin ise 5’tir.


Periyodik tabloda grupların özel isimleri de bulunmaktadır. 1A grubu alkali metaller, 2A grubu toprak alkali metaller, 7A grubu halojenler ve 8A grubu ise soy gazlar veya asal gazlardır.
Ayrıca bunları metaller, yarı metaller ve ametaller diye de gruplandırmamız mümkündür.