Düşünelim
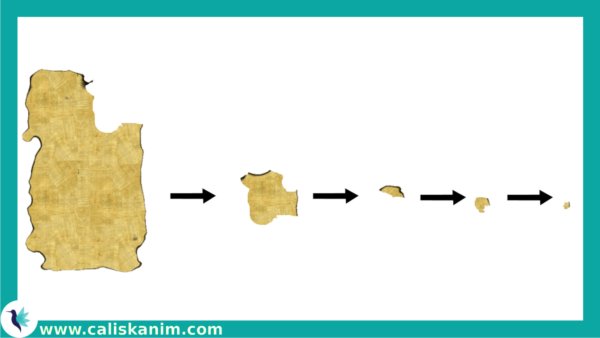
Bir kağıt parçasını kaç defa art arda bölebilirsiniz? Bunu sonsuza kadar götürmek mümkün müdür?
Tarihçe
Bundan yaklaşık 2000 yıl önce Democritus, bir maddenin sonsuza kadar bölünemeyeceğini ve mutlaka bölünme işleminin bir yerde son bulması gerektiği fikrini ortaya atarak maddelerin küçük taneciklerden meydana geldiğini söyledi.
Bu parçacıklara “Atomos” yani “Bölünemez” ismini verdi fakat bu fikir o zamanlar test edilemediğinden iddia olmaktan öteye geçemedi. O günden bugüne kadar atom üzerinden çok tartışmalar yaşandı ve atom hakkında bildiklerimiz sürekli değişti şimdi ise bu konu hakkında önemli bilgilere sahibiz.
Peki atom hakkında bilgilerimiz tarih içinde nasıl bir seyir izledi bu seyir ufkumuzu nasıl değiştirdi? Şimdi bunu görmeye hazırsanız arkanıza yaslanın ve okumanın keyfini çıkarın.
1- Dalton’un atom modeli
Dalton, maddenin en küçük parçasının “Atom” olduğunu söyleyerek atoma “içi dolu yoğun bir küredir” şeklinde bir açıklama getirdi.
Dalton’un atom modelini şu şekilde açıklamak mümkündür:
- Atom maddenin en küçük yapı taşıdır
- İçi dolu bir küre şeklindedir ve parçalanamaz (fakat Cabir bin Hayyan daha önce atomun parçalanabileceğini ifade etmişti)
- Her elementin atomu diğer elementin atomundan farklıdır
- Bir elementin tüm atomları birbirleri ile özdeştir
- Bu atomlar belirli oranlarda bir araya gelerek bileşikleri meydana getirirler. Bu durumu sabit oranlar ve katlı oranlar yasası ile ifade etmiştir.
2- Thomson atom modeli
J. J. Thomson katot ışınları ile yaptığı deneylerde ışınların sapmaya uğradığını fark etti bu durum atomun Dalton atom modelinde olduğu gibi tek parçadan meydana gelmediğini göstermekteydi.

Thomson atom modeline göre;
- Atomun proton (+) ve elektron (-) denilen iki parçadan meydana gelir,
- Elektronlar pozitif yük üzerinde homojen olarak dağılır,
- Bu dağılım üzümlü kek görüntüsüne sahiptir
- Elektronların toplam yükü pozitif yüke eşittir.
3- Rutherford atom modeli
Rutherford, daha önce alfa adını verdiği ve pozitif yüklü ağır tanecikleri biliyordu. Bu tanecikleri kullanarak Thomson atom modelini test etmek istedi.
Rutherford’un yapmaya çalıştığı şeyi şu şekilde anlatmaya çalışalım:

Elinize bir silah alıp biraz uzaklıktaki ince kağıt parçasına doğru ateş ettiğinizi düşünün. Bu durumda beklediğiniz sonuç nedir?
Hiç şüphesiz ağır kurşunların yönünü değiştirmeden kağıt parçasını delip geçeceğini düşünürsüz öyle değil mi? Çünkü kurşunlar oldukça ağır ve hızlı oldukları için kağıttan geri sapmaları imkansızdır.
Rutherford da bu şekilde bir beklenti içine girerek alfa parçacıklarını yüksek bir hızda ince altın levha üzerine yolladı. Burada alfa parçacıkları kurşunları, ince altın levha ise kağıdı temsil etmektedir.
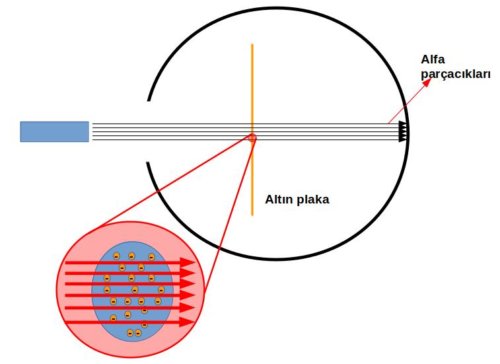
Fakat deney sonunda alfa parçacıklarının bir kısmı geri tepmişti bu kağıda sıkılan mermilerden bazılarının sekerek size gelmesi anlamına geliyordu ve beklenmeyen bir olaydı!
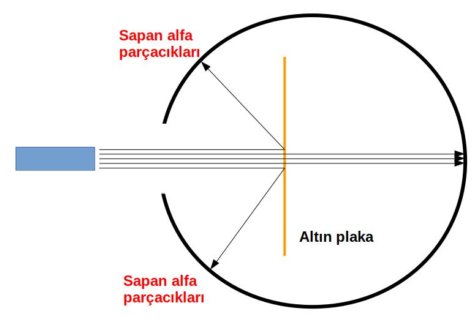
Deney sonucunda bazı alfa parçacıkları geri yansıyor. Bu beklenmedik bir sonuçtu.
Rutherford, Thomson atom modeli ile bu durumu açıklamayacağını anladı çünkü;
- Alfa parçacıklarının çoğunun sapmadan geçmesi atomun büyük kısmının boşluklardan meydana geldiğini ve
- Yansıyan az miktarda alfa parçacığı atomun küçük bir kısmında toplanan pozitif yüklü (neden pozitif yüklü?) bir çekirdek olduğunu gösteriyordu.
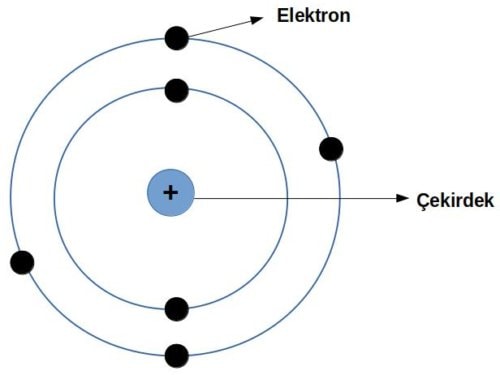
Bundan dolayı yeni bir model önermeye karar verdi. Güneş sistemini anımsatan bu modelde elektronlar pozitif yüklü bir çekirdek etrafından dönmekteydi ve çekirdek atomun çok küçük bir kısmını teşkil ediyordu.
Rutherford atom modeli atomların boşluklu yapısı ve çekirdeği hakkında açıklama verir fakat Rutherford atom modelinde elektronların yeri sabittir halbuki bizler elektronların ışıma yaptıklarını biliyoruz bu durum elektronların zamanla çekirdeğe yaklaşmasına ve bir süre sonra çekirdeğe çarpmasına neden olması gerekirdi.
Fakat bu olay hiç yaşanmaz! Yani elektronlar çekirdeğe düşmezler!
Rutherford atom modeli bu durumu açıklamada yetersiz kaldığı için eleştirilir.
4- Bohr atom modeli
Rutherford atom modeli ışıma yapan elektronların nasıl oluyor da çekirdeğe düşmediğini açıklayamadığı için yeni bir atom modeline ihtiyaç duyuldu.
Bohr ise elektronların nasıl ışıma yaptıklarını ve buna rağmen çekirdeğe neden düşmediklerini çok güzel açıklayabildiği için günümüzde de halen kullanılan yeni bir atom modeli önerdi.
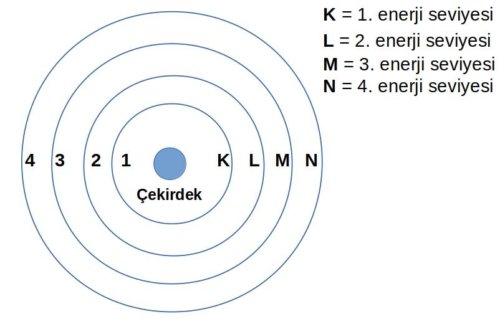
Bohr atom modeli özetle şunları söyler;
- Elektronlar çekirdeğin etrafında gezegenlerin güneş etrafında dolandıkları gibi dolanırlar (bu yönüyle Rutherford atom modeline benzer) bu yörüngelere enerji katmanları denir
- Enerji katmanları sırasıyla K, L, M ve N şeklinde isimlendirilir. K en düşük enerji katmanını, N en yüksek enerji katmanını temsil eder
- Elektronlar genellikle belirli enerji katmanında bulunur fakat atom uyarıldığı zaman farklı enerji katmanına geçebilirler bu durumda elektron ışıma yapar ama uyarılma ortadan kalktığı zaman tekrar eski enerji katmanına geri döner
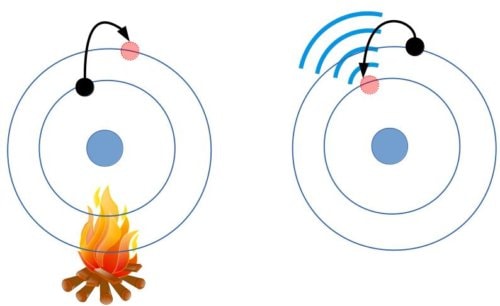

Her element farklı renkte ışıma yapar örneğin gaz deşarj lambalarında veya havai fişeklerde farklı renkte ışık elde etmek için farklı elementler kullanılır.
- 1

